Neuronale Zellen: Bessere Reprogrammierung
18.11.2020
Münchner Forscher können im Experiment Neurone aus Gliazellen gewinnen. Mit einem Trick läuft diese Umwandlung schneller und mit vierfach höherer Rate.
18.11.2020
Münchner Forscher können im Experiment Neurone aus Gliazellen gewinnen. Mit einem Trick läuft diese Umwandlung schneller und mit vierfach höherer Rate.
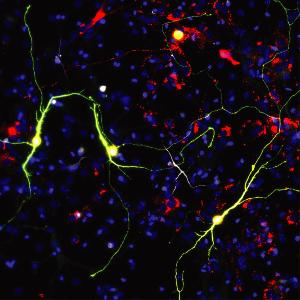
© Helmholtz Zentrum München
Neuronen (Nervenzellen) erfüllen wichtige Funktionen im Gehirn, zum Beispiel das Verarbeiten von Informationen. Bei vielen Erkrankungen des Gehirns, sei es durch Verletzung oder neurodegenerative Prozesse, sterben Neuronen ab. In der regenerativen Medizin sucht man deshalb nach Möglichkeiten, um Neuronen wiederherzustellen. Dabei gibt es drei Ansätze: die Transplantation, die Anregung von Stammzellen im Gehirn und die direkte Reprogrammierung von nicht-neuronalen Zelltypen in funktionale Neurone.
Wissenschaftlerinnen und Wissenschaftler des Helmholtz Zentrums München und der LMU haben in den letzten Jahren für die direkte Umwandlung von Gliazellen in Neuronen Pionierarbeit geleistet und diesen innovativen Ansatz auch ursprünglich entdeckt. Gliazellen sind der am häufigsten vorkommende Zelltyp im Gehirn. Besonders ist, dass sie sich nach einer Verletzung vermehren können. Derzeit können Forscher Gliazellen zwar in Neuronen umwandeln, dabei sterben jedoch viele Zellen ab. Dies bedeutet, dass nur wenige Gliazellen zu funktionalen Nervenzellen werden, was den Prozess ineffizient macht.
Magdalena Götz und ihr Team untersuchten, welche Hürden den Reprogammierungsprozess erschweren. Bisherige Studien konzentrierten sich vor allem auf die genetischen Aspekte der direkten neuronalen Umwandlung. Die Münchner hingegen entschieden sich, die Rolle der Mitochondrien und des Zellstoffwechsels genauer zu betrachten. Ausgangspunkt für diesen neuen Weg waren frühere Arbeiten zusammen mit der Gruppe von Marcus Conrad am Helmholtz Zentrum München. Dort zeigte man, dass Zellen aufgrund eines Überschusses an reaktiven Sauerstoffspezies (Sauerstoffradikalen) im Reprogrammierungsprozess absterben.
„Wir gingen davon aus, dass wir die Reprogammierung effizienter machen können, wenn wir den Stoffwechsel von Gliazellen so umwandeln, dass er dem Stoffwechsel von Neuronen gleicht“, erklärt Gianluca Russo, Erstautor der Studie. Aufgrund ihrer bisherigen Daten konzentrierte sich die Gruppe auf Mitochondrien, die „Kraftwerke“ der Zelle. Sie extrahierten die Mitochondrien aus Neuronen und aus bestimmten Gliazellen, den Astrozyten, von Mäusen. Dann verglichen sie gemeinsam mit Stefanie Haucks Proteom-Expertengruppe am Helmholtz Zentrum München die Unterschiede in den mitochondrialen Proteinen. Dabei fanden sie heraus, dass sich die Mitochondrien-Proteome von Neuronen und Astrozyten zu 20 Prozent unterscheiden.
„Da wir wussten, wie sehr sich das mitochondriale Proteom von Neuronen und Astrozyten unterscheidet, wollten wir herausfinden, ob reprogrammierte Neuronen, die aus Astrozyten entstanden sind, tatsächlich das mitochondriale Proteom eines Neurons besitzen oder nicht”, beschreibt Giacomo Masserdotti, einer der Letztautoren der Studie, das weitere Vorgehen. In einem Standard-Reprogrammierungsprozess gelingt es, Gliazellen wie Astrozyten innerhalb von wenigen Tagen in Neuronen umzuwandeln, die sich dann innerhalb von zwei Wochen zu funktionalen Neuronen weiterentwickeln. „Wir sahen, dass Zellen erst relativ spät in dem Reprogrammierungsprozess, nach einer Woche, mitochondriale Proteine besitzen, die typisch für Neuronen sind. Da die meisten Zellen vorher sterben, könnte dies ein Hindernis sein. Zudem zeigen die Zellen, die nicht konvertiert sind, immer noch die mitochondrialen Proteine der Astrozyten.“ Daraus schlossen die Wissenschaftler, dass es den Reprogrammierungsprozess blockieren könnte, wenn eine Aktivierung neuronaler mitochondrialer Proteine ausbleibt.
Um diese Hürde zu überwinden, nutzte die Gruppe CRISPR/Cas9-Technologie in enger Zusammenarbeit mit den Arbeitsgruppen von Stefan Stricker und Wolfgang Wurst am Helmholtz Zentrum München. Mit neuen Tools, die diese Gruppe zur Aktivierung von Genen entwickelt hat, konnten mitochondriale Proteine, die gehäuft in Neuronen vorkommen, in einem frühen Stadium des Reprogrammierungsprozesses von Astrozyten in Neuronen angeschaltet werden. Die Manipulation von nur ein bis zwei mitochondrialen Proteinen führte zu einer viermal höheren Anzahl von Neuronen. Darüberhinaus entwickelten sich die Neuronen schneller und reiften auch schneller aus, wie die fortlaufende Live-Bildgebung zeigte.
„Ich war erstaunt, dass die geänderte Expression so weniger mitochondrialer Proteine die Umwandlung derart beschleunigte“, sagt Magdalena Götz, Leiterin der Studie. „Dies zeigt uns, wie wichtig die Unterschiede der mitochondrialen Proteine bei verschiedenen Zellen sind. Und tatsächlich sind wir gerade gemeinsam mit dem Team von Stefanie Hauck dabei, weitere organellare Unterschiede zwischen den Zelltypen zu entdecken. Sie unterscheiden sich teilweise in bis zu 70 Prozent. Mit diesem Wissen werden wir künftig reprogrammierte Neurone bilden können, die den körpereigenen Neuronen so ähnlich wie möglich sind – nach Gehirnverletzungen in vivo.“ (Helmholtz Zentrum München/LMU)
Cell Stem Cell 2020