Wie das Signalprotein ECT2 die Zellteilung steuert
02.03.2021
Während sich die Chromosomen aufteilen, beginnen sich Zellen abzuschnüren und sich schließlich zu trennen. Diesen Schlüsselschritt koordiniert ECT2.
02.03.2021
Während sich die Chromosomen aufteilen, beginnen sich Zellen abzuschnüren und sich schließlich zu trennen. Diesen Schlüsselschritt koordiniert ECT2.
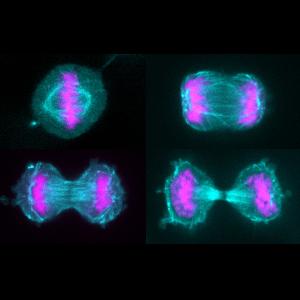
Stadien der Zellteilung in menschlichen HeLa-Zellen. Der Spindelapparat ist cyan angefärbt, die Erbinformation pink. | © Friederike Wolff, Zanin Group
Während der Entstehung eines neuen Organismus und während des gesamten Lebens teilen sich Zellen viele Millionen Mal. Dabei wird die genetische Information der Mutterzelle verdoppelt und an die zwei Tochterzellen weitergegeben. Nur so kann ein Embryo wachsen oder ein bestimmtes Gewebe im Körper erneuert werden.
Die Zellteilung ist ein komplexer Vorgang, der damit beginnt, dass die Erbinformation im Zellkern kopiert wird. Danach wird die Erbinformation in Chromosomen, Strukturen aus Erbgut und aus Proteinen, verpackt. Schließlich zerfällt die Hülle des Zellkerns und eine faserartige Struktur, der Spindelapparat, entsteht. Mit Hilfe des Spindelapparats ordnen sich die Chromosomen in der Äquatorebene der Zelle an. Sie werden in der Anaphase auseinandergezogen. Zeitgleich schnürt sich die Mutterzelle in der Mitte ab und die zwei Tochterzellen entstehen. Am Ende der Zellteilung enthält jede Tochterzelle eine Kopie des Erbguts der Mutterzelle.
Esther Zanin, die eine Forschungsgruppe am Biozentrum der LMU leitet, untersucht speziell die Zytokinese, die Teilung der Mutterzelle in zwei Tochterzellen. „Defekte während dieser Phase können zu Geburtsfehlern oder zu Krebs führen“, sagt die LMU-Wissenschaftlerin. „Das Ziel unserer Arbeit ist, molekulare Mechanismen aufzudecken, welche die Zytokinese räumlich und zeitlich steuern.“
Während dieses zentralen Vorgangs entsteht ein Aktin-Myosin-Ring am Zelläquator, der sich langsam zusammenzieht. Aktin und Myosin sind keine Unbekannten. Sie spielen auch bei der Muskelkontraktion die zentrale Rolle. Die Bildung des Aktin-Myosin-Rings muss zeitlich mit dem Fortschreiten des Zellzyklus und räumlich mit der Aufteilung der Chromosomen in den neu entstehenden Tochterzellen koordiniert werden.
„Die zeitliche und räumliche Kontrolle ist immens wichtig: Die Mutterzelle darf sich ja erst abschnüren, wenn sich die Chromosomen aufgeteilt haben“, erklärt Zanin. Bisher wussten Forscher, dass ein spezielles Signalprotein, genannt ECT2, die Bildung des Aktin-Myosin-Rings auslöst. Wie die Aktivität von ECT2 gesteuert wird, war bisher nur lückenhaft verstanden.
ECT2 ist ein recht großes Protein, das aus verschiedenen Untereinheiten, sogenannten Domänen, besteht. Wissenschaftler vermuteten, dass einige Domänen zur Aktivierung und andere zur Inhibierung der Aktivität von ECT2 beitragen. Stimmt diese Hypothese?
Zanin hat zusammen mit ihrem Team einzelne Domänen von ECT2 in menschlichen Zellen nacheinander ausgeschaltet, um zu sehen, welche Folgen dies für die Bildung des Aktin-Myosin-Rings und die Zellteilungen hat. „Überraschenderweise zeigte sich, dass verschiedene Domänen gegensätzliche Aufgaben bei der Regulation der Aktivität von ECT2 erfüllen“, fasst die Wissenschaftlerin zusammen. Auch konnte gezeigt werden, dass die verschiedenen Domänen ganz bestimmte Signalmoleküle binden und somit vermutlich unterschiedliche Signale integrieren. Alles in allem ist die Regulation komplexer als angenommen.
Dennoch bleiben einige Fragen offen. Zanin: „Wir planen, weiter an dieser Thematik zu arbeiten. Im nächsten Schritt wollen wir verstehen, wie das Andocken der Signalmoleküle an die verschiedenen Domänen die Aktivität von ECT2 erhöht oder reduziert." Außerdem geht aus früheren Untersuchungen hervor, dass ECT2 in Krebsgeweben häufig Mutationen aufweist. „Ob es sich um die Ursache oder die Wirkung maligner Erkrankungen handelt, wissen wir derzeit nicht“, so die LMU-Forscherin. Hier ergeben sich ebenfalls Ansatzpunkte für neue Projekte.