Adipositas: Gefährliche Immunantwort
16.03.2022
Falsche Ernährung führt zu fataler Aktivierung von Immunzellen. Ein Forschungsteam der LMU hat nun in Kooperation mit der Harvard Medical School in Boston neue molekulare Zusammenhänge entschlüsselt.
16.03.2022
Falsche Ernährung führt zu fataler Aktivierung von Immunzellen. Ein Forschungsteam der LMU hat nun in Kooperation mit der Harvard Medical School in Boston neue molekulare Zusammenhänge entschlüsselt.

Ebenso beliebt wie ungesund: Currywurst mit Pommes | © IMAGO / Westend61
Übergewicht und Adipositas sind eine der größten gesundheitlichen Herausforderungen des 21. Jahrhunderts, schreibt die Weltgesundheitsorganisation (WHO). Knapp 60 Prozent der Deutschen gelten als übergewichtig, 25 Prozent als adipös. Übergewicht ist dabei häufig der Auslöser für schwere Folgeerkrankungen wie Diabetes, Arteriosklerose oder Herzinfarkte.
Sorgen macht Medizinern dabei das Fettgewebe im Bauchraum, das sogenannte viszerale Fettgewebe, dessen starke Zunahme mit einer den ganzen Körper erfassenden Entzündungsantwort einhergeht und so das Risiko für Folgeerkrankungen ansteigen lässt. Das viszerale Fettgewebe spielt bei diesen Prozessen eine bedeutende Rolle, da sich Immunzellen hier in lymphoiden Strukturen anordnen und Immunantworten einleiten können, die den Stoffwechsel entgleisen lassen.
Bereits nach drei Wochen fettreicher, hochkalorischer Diät verändern sich die molekularen Prozesse im Organismus, die das Immunsystem und den Stoffwechsel steuern.Susanne Stutte
Ein Forscherteam der LMU hat jetzt die molekularen Prozesse untersucht, die diesen sogenannten Immun-Metabolismus beeinflussen. Dabei spielt die Ernährung eine entscheidende Rolle: „Bereits nach drei Wochen fettreicher, hochkalorischer Diät verändern sich die molekularen Prozesse im Organismus, die das Immunsystem und den Stoffwechsel steuern“, erklärt Dr. Susanne Stutte vom Biomedizinischen Centrum und Erstautorin der Studie. Überschüssige Nahrungsenergie wird in weißem Fettgewebe, sogenanntem Viszeralfett, gespeichert und lagert sich im ganzen Körper und zwischen den inneren Organen an. Das hat zwar jeder Mensch, doch es kann durch eine besonders kalorien- oder fettreiche Ernährung stark anwachsen und damit gesundheitsgefährdend werden.
Mit dem stetigen Wachstum des Viszeralfetts geraten auch immunologische Prozesse aus dem Gleichgewicht, wie die Forscher zeigen konnten: Bestimmte Immunzellen, sogenannte plasmazytoide dendritische Zellen (pDCs) akkumulieren nun im Fettgewebe. „Es bildet sich hier ein tertiäres lymphatische Gewebe, in dem die pDCs nun in fataler Weise Immunsystem und Stoffwechsel ansteuern“, erklärt Stutte.
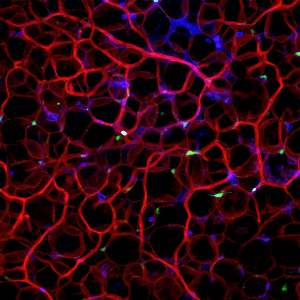
Gefäßsystem im murinen viszeralem Fettgewebe (Rot: Blutgefäße, grün: pDCs, blau: hämatopoetische Zellen)
Je mehr Fett sich bildet, desto mehr dieser Strukturen entstehen. Sie greifen akut in den Stoffwechsel ein, wodurch ein metabolisches Syndrom entsteht. Das bedeutet, dass sich die pDCs im Viszeralfett in ständiger Alarmbereitschaft befinden.
„Die pDCs stellen normalerweise die erste Barriere bei einer viralen Infektion dar, bei der sie reagieren und einen Botenstoff (das Typ-1-Interferon) ausschütten, der das Immunsystem reguliert“, erklärt Professorin Barbara Walzog vom Walter-Brendel-Zentrum für Experimentelle Medizin der LMU und Leiterin des SFB 914 „Trafficking of Immune Cells in Inflammation, Development and Disease“. Tritt das metabolische Syndrom ein, entgleist der Stoffwechsel und die Entzündungswerte steigen. „Schon nach drei Wochen hochkalorischer Ernährung konnten wir die Entstehung von Typ-2-Diabetes feststellen, induziert durch das wachsende Viszeralfett“, berichtet Stutte.
Die Ergebnisse entstanden in Kooperation mit der Harvard Medical School und können nach Ansicht der Wissenschaftlerinnen und Wissenschaftler dazu beitragen, neue Ansatzpunkte für eine therapeutische Intervention zu entwickeln.
Die Einwanderung der Zellen in das Fettgewebe folgt exakten molekularen Mustern, die man sich wie Landkarten vorstellen kann. „Wenn man etwa verhindern könnte, dass pDCs ins Fett gelangen, könnte man möglicherweise auch die resultierenden Folgeerkrankungen verhindern“, erklärt Walzog.
Susanne Stutte, Hellen Ishikawa-Ankerhold, Lydia Lynch, Sarah Eickhoff, Simona Nasiscionyte, Chenglong Guo, Dominic van den Heuvel, Daniel Setzensack, Marco Colonna, Daniela Maier-Begandt, Ludwig Weckbach, Thomas Brocker, Christian Schulz, Barbara Walzog and Ulrich von Andrian:
High-Fat Diet Rapidly Modifies Trafficking, Phenotype, and Function of Plasmacytoid Dendritic Cells in Adipose Tissu. In: The Journal of Immunology 2022